Les solides cristallins sont caractérisés par un assemblage régulier d'atome d'ion ou de molécule. Dans un solide cristallin les éléments qui le constituent forment un réseau.
La plus petite structure élémentaire du réseau est appelée maille élémentaire. Il existe plusieurs types de cristaux:
- Les cristaux ioniques formés des ions liés par des inter actions électrostatiques, exemple: Nacl ou les ions Na+ et Cl- sont repartis de façon très ordonnée.
- Les cristaux covalents formés d'atome liés par des forces covalentes, exemple: le diamant.
- Les alliages formés de plusieurs types d'atome liés par des liaisons mécaniques.
- Les cristaux moléculaires formés de molécules liés par les liaisons moléculaires.
Les réseaux métalliques
L'édifice chimique est caractérisé par une distribution spatiale des éléments (électrons, atomes ou molécule). Dans un métal pur les particules sont identiques. Ces particules sont constituées d'atomes d'où le nom d'ion positif. Les électrons libérés expliquent le mécanisme de conduction électrique et thermique des métaux. La plus part des métaux cristallisent dans deux types de réseau: le réseau cubique et le réseau hexagonal.
Le système cubique existe sur deux formes (cubique centré et cubique à face centrée).
Dans le système cubique centré on a un atome au centre de chaque face.
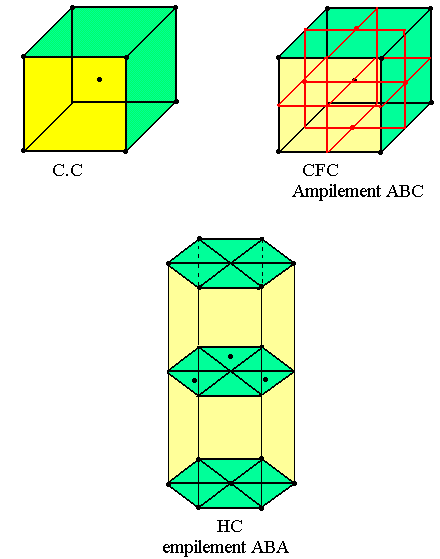
Le système hexagonal compact comprend des électrons disposés en couche. Sur la première couche (A). Les atomes sont disposés à chaque sommet de l'hexagone et au centre. Sur la deuxième couche (B) on a trois atomes logés sur les sites laissés vides par 3 atomes au-dessus. La troisième couche est identique à la première.
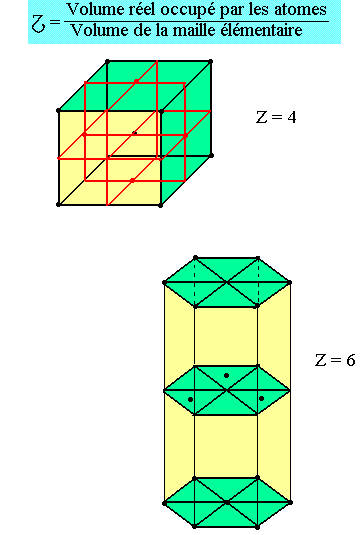
On appelle natif, le réel noté Z représentant le nombre d'atome propre à une maille élémentaire.
On appelle taux de compacité le rapport des volumes réellement occupés par les atomes et de la maille.
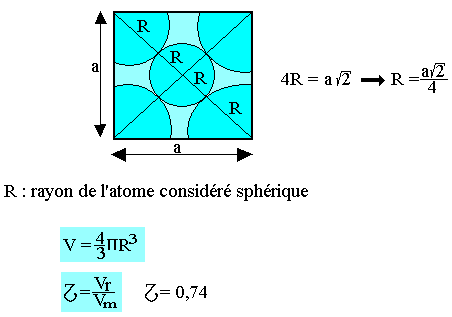
Etude du réseau cubique à face centrée
Soit a l'arrête du cube.