Equation bilan
Nous nous servons d'un exemple: On mélange 23g de sodium (Na) à 35,5g de chlore. Le produit obtenu a un goût salé. C'est le chlore de sodium.
Exemple 1:
On peut dire que:
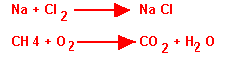
Na + Cl2 donne NaCl; où:
- Na + Cl2 = sodium dichlore (réactifs)
- NaCl = Chlorure de sodium (Produit)
Le sodium et le chlore ont disparu pour laisser place à un composé qui est le chlorure de sodium.
Les produits qui disparaissent sont les réactions et ceux qui apparaissent sont les produits.
Exemple 2:
On mélange du méthane avec du dioxygène, on obtient du dioxyde de carbone plus de l'eau.
CH4 + O2 donne CO2 + H2O
La réaction chimique est une transformation au cours de laquelle des corps purs disparaissent (réactifs) et de corps purs nouveaux apparaissent (produits). Nous devons noter qu'au cours d'une réaction chimique il y'a conservation de la matière: les éléments qui constituent les réactifs sont les mêmes qui constituent les produits.
Il y'a conservation de la masse. La masse des réactifs est égale à la masse des produits.
Représentation d'une réaction chimique
La réaction chimique se représente par sont équation bilan. Pour écrire l'équation bilan, on écrit à gauche les formules de réactifs séparées par des signes +, à droite les formules des produits séparées également par des signes +. Les 2 membres sont reliés par une flèche allant des réactifs vers les produits.
Dans l'écriture d'équation bilan, nous devons respecter la conservation de la matière puis la conservation de la masse, pour cela nous somme appelés à équilibrer l'équation bilan. C'est une opération qui consiste à placer devant la formule de chaque corps un cœfficient appelé cœfficient Stoechiométrique afin que les éléments des produits se retrouvent en même genre et nombre dans les produits.
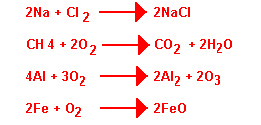
Les réactions avec l'oxygène sont appelées combustion. Elles dégagent de la chaleur, elles sont dites exothermiques, contrairement aux réactions endothermiques qui absorbent de la chaleur.
Certaines réactions nécessitent d'être accélérées pour avoir lieu. Ces réactions sont dites catalytiques. Le composé qui accélère la réaction s'appelle le catalyseur. On le retrouve intact à la fin de la réaction. C'est donc un corps qui favorise la réaction sans pourtant y participer.
![]()
Alors que
![]()
Autres réactions:
Action du dihydrogène sur l'oxyde de cuivre II.
![]()
Synthèse de l'ammoniaque
![]()
Hydrolyse du carbone de calcium
![]()
Résolution de l'exercice de chimie
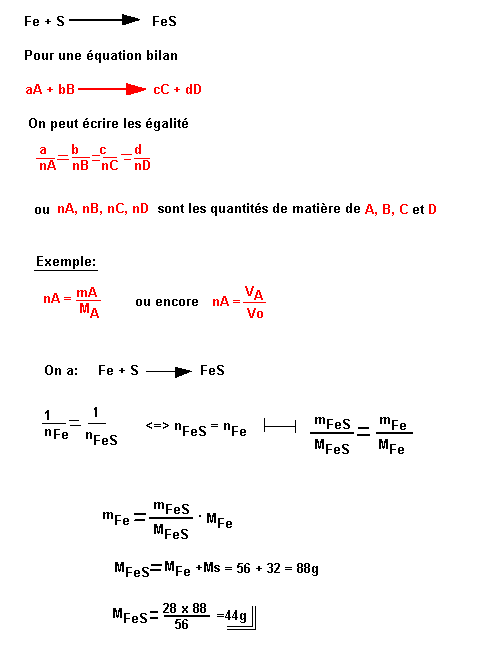
L'action du soufre sur le fer conduit au sulfure de fer. Ecrire l'équation bilan de la réaction.
Quelle masse de sulfure de fer obtient-on à partir de 28g de fer. On donne les masses molaires atomiques.
Fe = 56g.m-1; S = 32g.m-1; mFe = 28g; mFeS = ?
Résolution: