On appelle hydrocarbure les composés organiques constitués essentiellement du carbone et de l'hydrogène. Les alcanes hydrocarbures dit saturés ont pour formule brute générale CnH2n+2
Exemple:
CH4 : méthane
C2H3 : éthane
C3H8 : propane
C4H10 : butane
Les alcanes ont une grande réactivité pour les réactions de substitution.
Les alcènes et les alcynes dit hydrocarbure insaturés ou saturés ont pour formule respective alcène: CnH2n ; alcynes: CnH2n-2
Les alcènes :
- C2H4 éthylène
- C3H6 propène
- C4H8 butène
Les alcynes :
- C2H2 acétylène
- C3H4 propyne
- C4H6 butyne
Les alcènes et les alcynes se caractérisent par une liaison multiple entre carbone.
Le benzène est le premier composé dans la catégorie des aromatiques. Sa structure est plane. Le benzène a une réactivité par rapport aux réactions d'addition.
Nomenclature
Les alcanes
Pour nommer un alcane:
- On cherche la chaîne la plus longue appelée chaîne principale. Le nom de l'alcane est déterminé par le nombre de carbone.
- On détermine des groupes alkyles (ramification) en numérotant les atomes de carbone de la chaîne principale. L'ensemble des chiffres forme un nombre donc la valeur doit être la plus petite.
- Le nom de l'alcane ramifié s'obtient en écrivant le nom de l'alcane correspondant à la chaîne principale précédé des noms des groupes alkyle fixés sur cette chaîne eux-mêmes précédés de leur indice de position. Lorsque plusieurs groupes sont identiques on utilise le préfixe identifiant leur nombre (décri, tétra)
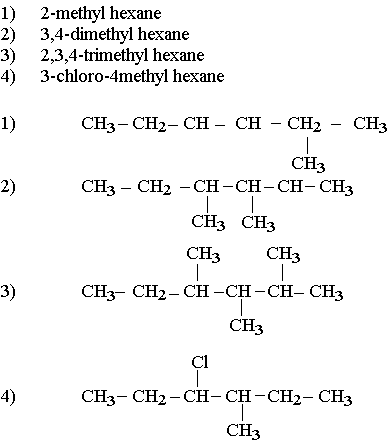
Nomenclature des alcanes:
|
CH4: méthane |
C6H14: Hexane |
|
C2H6: éthane |
C7H16: heptane |
|
C3H8: propane |
C8H18: octane |
|
C4H10: butane |
C9H20: nonane |
|
C5H12: pentane |
C10H22: décane |
Les préfixes méth - éth - prop et but caractérisent les composés à 1; 2; 3; 4 atomes de carbone.
Formule des alcanes CnH2n+2
Les groupes alkyle:
Le nom de ce groupe est obtenu en remplaçant dans le nom de l'alcane le suffixe "ane" par le suffixe "yle".
Citons à titre d'exemple:
CH3: groupe méthyle
C2H5: groupe éthyle.
La formule générale d'un groupe alkyle est CnH2n+1
Alcène et Alcyne
Pour nommer un alcène ou un alcyne on procède de la même façon que pour nommer un alcane dans le nom final on remplace le suffixe ane par ène pour un alcène et yne pour un alcyne précédé de l'indice de position de la liaison possible.
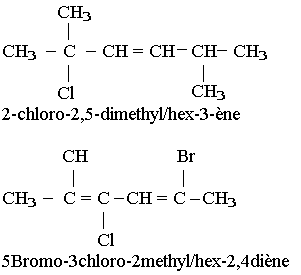
Propriété chimique
Combustion
Les hydrocarbures brûlent dans le dioxygène pour donner le gaz carbonique CO2 et de l'eau. Cette réaction est exothermique.
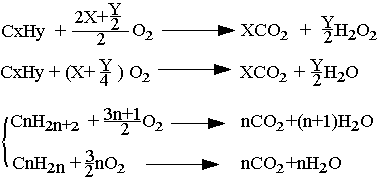
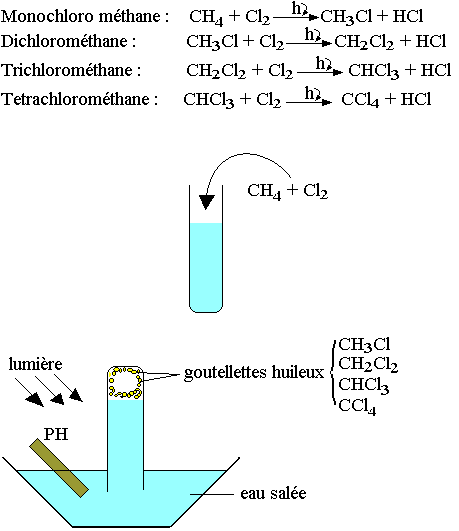
Réaction de substitution
Les réactions d'halogénation sont les substitutions des alcanes par le dichlore et le dichrome essentiellement.
Réaction d'addition
La réaction des alcènes et des alcynes est très souvent due à la présence d'une ou de deux liaisons Pi
Hydrogénation des alcènes et des alcynes
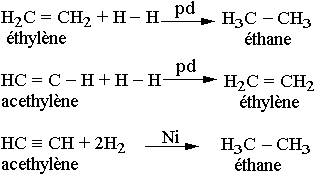
Hydratation
Remarque: Lors d'une hydratation des alcènes dissymétriques, l'hydrogène de l'eau se fixe sur le carbone le plus hydrogéné, c'est la règle de Markov Nikov. Il est de même pour l'addition du chlorure d'hydrogène.
Le benzène et les composés aromatiques
On appelle composé aromatique tout composé aromatique comportant un noyau benzénique. Ils sont appelés composés aromatiques à raison de leur odeur forte.
Le benzène a pour formule brute C6H6
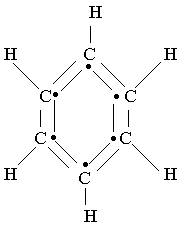
La formule développée plane montre que chacun des 6 carbones possèdent un électron libre. Les 6 électrons libres constituent le noyau benzénique, ils sont délocalisés.
Addition du benzène
Hydrogénation:
En présence du platium ou nickel à 200°C le dihydrogène agit sur le benzène pour donner le cyclohexane.
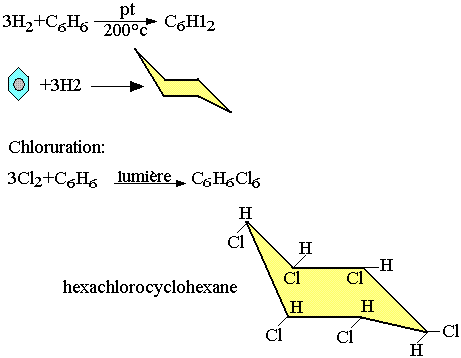
Substitution du benzène
Halogénation:
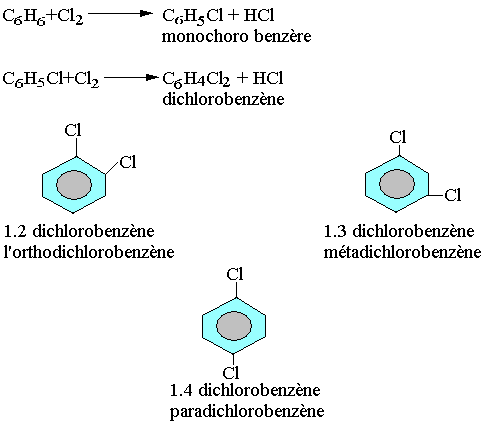
Nitration:
Le benzène réagit avec l'acide nitrique concentré NHO3 en présence de l'acide sulfurique concentré (catalyseur et déshydratant). La réaction se passe à froid.
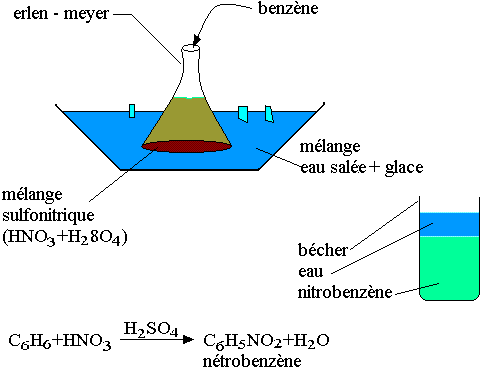
Si la température s'élève on peut obtenir le 1,3 dinitrobenzène et le 1,3,5 trinitrobenzène. Dans les mêmes conditions on peut obtenir le 1-methyl-2,4,6-trinitrobenzène.
